摘要:研究人員現(xiàn)在發(fā)現(xiàn),已知會(huì)增加一個(gè)人患糖尿病風(fēng)險(xiǎn)的DNA序列變化與胰腺細(xì)胞處理兩種不同分子壓力的能力有關(guān)。
胰腺細(xì)胞和人一樣,只能承受一定的壓力,然后就會(huì)開(kāi)始崩潰。某些壓力源,如炎癥和高血糖,會(huì)使這些細(xì)胞不堪重負(fù),從而導(dǎo)致2型糖尿病的發(fā)展。
杰克遜實(shí)驗(yàn)室(JAX)的研究人員現(xiàn)在發(fā)現(xiàn),已知會(huì)增加一個(gè)人患糖尿病風(fēng)險(xiǎn)的DNA序列變化與胰腺細(xì)胞處理兩種不同分子壓力的能力有關(guān)。在有這些DNA變化的人身上,胰腺中產(chǎn)生胰島素的細(xì)胞在暴露于壓力和炎癥時(shí)可能更容易衰竭或死亡。
JAX副教授Michael L. Stitzel和JAX教授Dugyu Ucar共同撰寫(xiě)了這項(xiàng)新研究,該研究發(fā)表在10月8日的《細(xì)胞代謝》高級(jí)在線版上,他說(shuō):“最終,我們希望通過(guò)針對(duì)最易患這種疾病的人的基因和途徑,開(kāi)發(fā)出預(yù)防和治療2型糖尿病的新方法。”“這些發(fā)現(xiàn)讓我們對(duì)其中一些基因和途徑有了新的認(rèn)識(shí)。”
這項(xiàng)工作指出了幾十個(gè)與細(xì)胞壓力和糖尿病風(fēng)險(xiǎn)有關(guān)的基因,其中一個(gè)基因已經(jīng)在研究中,可以作為治療2型糖尿病并發(fā)癥的藥物靶點(diǎn)。

圖1 多組分人胰島內(nèi)質(zhì)網(wǎng)和細(xì)胞因子應(yīng)激反應(yīng)圖譜提供了2型糖尿病的遺傳見(jiàn)解
壓力下的細(xì)胞
當(dāng)活細(xì)胞面臨挑戰(zhàn),包括損傷、炎癥或營(yíng)養(yǎng)變化時(shí),它們會(huì)激活保護(hù)性反應(yīng),試圖應(yīng)對(duì)和逆轉(zhuǎn)壓力。但隨著時(shí)間的推移,持續(xù)的壓力會(huì)壓倒細(xì)胞,導(dǎo)致它們減緩或死亡。
在胰島β細(xì)胞中,兩種類(lèi)型的細(xì)胞壓力與2型糖尿病的發(fā)展有關(guān)。
內(nèi)質(zhì)網(wǎng)(ER)應(yīng)激發(fā)生時(shí),細(xì)胞變得不堪重負(fù)的高需求產(chǎn)生蛋白質(zhì),如胰島素,以幫助調(diào)節(jié)血糖水平。
當(dāng)免疫系統(tǒng)發(fā)出過(guò)多的炎癥信號(hào)時(shí),細(xì)胞因子壓力就會(huì)發(fā)生——就像肥胖和代謝疾病一樣。
在這兩種情況下,壓力最終會(huì)導(dǎo)致胰島細(xì)胞停止產(chǎn)生胰島素或死亡。
Stitzel和他的同事們想知道胰島細(xì)胞使用了哪些基因和蛋白質(zhì)來(lái)對(duì)內(nèi)質(zhì)網(wǎng)應(yīng)激和細(xì)胞因子應(yīng)激做出反應(yīng)。
Stitzel說(shuō):“研究人員已經(jīng)完成了多項(xiàng)研究,以了解哪些分子途徑在調(diào)節(jié)快樂(lè)、健康的胰島細(xì)胞的胰島素分泌中起重要作用。”“但我們的假設(shè)是,胰島細(xì)胞并不總是快樂(lè)的。那么,當(dāng)細(xì)胞處于壓力下時(shí),哪些途徑是重要的?我們每個(gè)人體內(nèi)與糖尿病相關(guān)的DNA序列變化是如何影響它們的?”
應(yīng)激反應(yīng)的基因
Stitzel的研究小組將健康的人類(lèi)胰島細(xì)胞暴露于已知會(huì)引起內(nèi)質(zhì)網(wǎng)應(yīng)激或細(xì)胞因子應(yīng)激的化合物中。然后,他們追蹤細(xì)胞中RNA分子水平的變化,以及細(xì)胞內(nèi)不同DNA片段排列的緊密程度或松散程度——這是細(xì)胞在任何給定時(shí)間使用哪些基因和調(diào)控元件的代理。
為了分析結(jié)果,該團(tuán)隊(duì)與JAX的教授兼計(jì)算生物學(xué)家Ucar合作。科學(xué)家們共同發(fā)現(xiàn),超過(guò)5000個(gè)基因,或健康胰島細(xì)胞表達(dá)的所有基因的近三分之一,在內(nèi)質(zhì)網(wǎng)壓力或細(xì)胞因子壓力下改變了它們的表達(dá)。其中許多參與了蛋白質(zhì)的產(chǎn)生,這對(duì)胰島細(xì)胞產(chǎn)生胰島素至關(guān)重要。大多數(shù)基因只參與一種或另一種應(yīng)激反應(yīng),提出了兩種不同的應(yīng)激途徑在糖尿病中起作用的觀點(diǎn)。
此外,大約八分之一的用于胰島細(xì)胞的DNA調(diào)節(jié)區(qū)域被壓力改變。重要的是,這些調(diào)控區(qū)域中有86個(gè)先前被發(fā)現(xiàn)含有2型糖尿病高危人群的遺傳變異。
Stitzel說(shuō):“這表明,具有這些基因變異的人的胰島細(xì)胞對(duì)壓力的反應(yīng)可能比其他人更差。”“你的環(huán)境——比如糖尿病和肥胖——觸發(fā)了2型糖尿病,但你的基因是扳機(jī)的扳機(jī)。”
Stitzel希望新的調(diào)控區(qū)域和基因列表最終能夠通過(guò)潛在地使胰島細(xì)胞更能適應(yīng)壓力而產(chǎn)生預(yù)防或治療糖尿病的新藥。
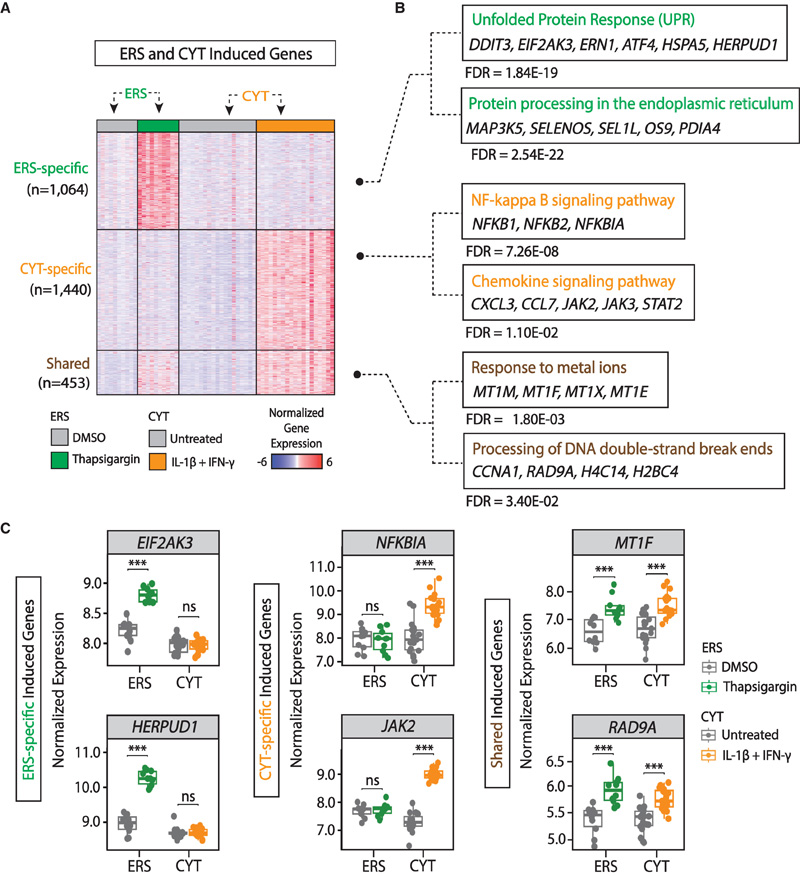
圖2 人胰島ER應(yīng)激和細(xì)胞因子反應(yīng)基因的綜合比較圖譜
一個(gè)可用藥的目標(biāo)
研究人員找到了一個(gè)被內(nèi)質(zhì)網(wǎng)應(yīng)激改變的基因。該基因被稱(chēng)為MAP3K5,在胰島素編碼基因中含有引起糖尿病的突變的小鼠中,被證明可以改變胰島β細(xì)胞的死亡。
在這篇新論文中,Stitzel和他的同事們表明,更高水平的MAP3K5導(dǎo)致更多的胰島β細(xì)胞在內(nèi)質(zhì)網(wǎng)應(yīng)激下死亡。另一方面,消除或阻斷MAP3K5使胰島細(xì)胞對(duì)內(nèi)質(zhì)網(wǎng)應(yīng)激更有彈性,更不容易死亡。
針對(duì)MAP3K5的藥物Selonsertib的早期研究表明,它可以降低糖尿病嚴(yán)重并發(fā)癥的風(fēng)險(xiǎn)。新的研究結(jié)果指出了這種藥物的另一個(gè)可能的作用——在糖尿病高危人群中預(yù)防糖尿病,幫助他們的胰島細(xì)胞在細(xì)胞壓力下保持功能和活力。
Stitzel說(shuō):“這種治療方法已經(jīng)在臨床試驗(yàn)中,這確實(shí)令人興奮,但要了解這種藥物是否能夠用于初級(jí)預(yù)防,還需要做更多的工作。”
參考資料
[1] Multi-omic human pancreatic islet endoplasmic reticulum and cytokine stress response mapping provides type 2 diabetes genetic insights
摘要:研究人員現(xiàn)在發(fā)現(xiàn),已知會(huì)增加一個(gè)人患糖尿病風(fēng)險(xiǎn)的DNA序列變化與胰腺細(xì)胞處理兩種不同分子壓力的能力有關(guān)。
胰腺細(xì)胞和人一樣,只能承受一定的壓力,然后就會(huì)開(kāi)始崩潰。某些壓力源,如炎癥和高血糖,會(huì)使這些細(xì)胞不堪重負(fù),從而導(dǎo)致2型糖尿病的發(fā)展。
杰克遜實(shí)驗(yàn)室(JAX)的研究人員現(xiàn)在發(fā)現(xiàn),已知會(huì)增加一個(gè)人患糖尿病風(fēng)險(xiǎn)的DNA序列變化與胰腺細(xì)胞處理兩種不同分子壓力的能力有關(guān)。在有這些DNA變化的人身上,胰腺中產(chǎn)生胰島素的細(xì)胞在暴露于壓力和炎癥時(shí)可能更容易衰竭或死亡。
JAX副教授Michael L. Stitzel和JAX教授Dugyu Ucar共同撰寫(xiě)了這項(xiàng)新研究,該研究發(fā)表在10月8日的《細(xì)胞代謝》高級(jí)在線版上,他說(shuō):“最終,我們希望通過(guò)針對(duì)最易患這種疾病的人的基因和途徑,開(kāi)發(fā)出預(yù)防和治療2型糖尿病的新方法。”“這些發(fā)現(xiàn)讓我們對(duì)其中一些基因和途徑有了新的認(rèn)識(shí)。”
這項(xiàng)工作指出了幾十個(gè)與細(xì)胞壓力和糖尿病風(fēng)險(xiǎn)有關(guān)的基因,其中一個(gè)基因已經(jīng)在研究中,可以作為治療2型糖尿病并發(fā)癥的藥物靶點(diǎn)。

圖1 多組分人胰島內(nèi)質(zhì)網(wǎng)和細(xì)胞因子應(yīng)激反應(yīng)圖譜提供了2型糖尿病的遺傳見(jiàn)解
壓力下的細(xì)胞
當(dāng)活細(xì)胞面臨挑戰(zhàn),包括損傷、炎癥或營(yíng)養(yǎng)變化時(shí),它們會(huì)激活保護(hù)性反應(yīng),試圖應(yīng)對(duì)和逆轉(zhuǎn)壓力。但隨著時(shí)間的推移,持續(xù)的壓力會(huì)壓倒細(xì)胞,導(dǎo)致它們減緩或死亡。
在胰島β細(xì)胞中,兩種類(lèi)型的細(xì)胞壓力與2型糖尿病的發(fā)展有關(guān)。
內(nèi)質(zhì)網(wǎng)(ER)應(yīng)激發(fā)生時(shí),細(xì)胞變得不堪重負(fù)的高需求產(chǎn)生蛋白質(zhì),如胰島素,以幫助調(diào)節(jié)血糖水平。
當(dāng)免疫系統(tǒng)發(fā)出過(guò)多的炎癥信號(hào)時(shí),細(xì)胞因子壓力就會(huì)發(fā)生——就像肥胖和代謝疾病一樣。
在這兩種情況下,壓力最終會(huì)導(dǎo)致胰島細(xì)胞停止產(chǎn)生胰島素或死亡。
Stitzel和他的同事們想知道胰島細(xì)胞使用了哪些基因和蛋白質(zhì)來(lái)對(duì)內(nèi)質(zhì)網(wǎng)應(yīng)激和細(xì)胞因子應(yīng)激做出反應(yīng)。
Stitzel說(shuō):“研究人員已經(jīng)完成了多項(xiàng)研究,以了解哪些分子途徑在調(diào)節(jié)快樂(lè)、健康的胰島細(xì)胞的胰島素分泌中起重要作用。”“但我們的假設(shè)是,胰島細(xì)胞并不總是快樂(lè)的。那么,當(dāng)細(xì)胞處于壓力下時(shí),哪些途徑是重要的?我們每個(gè)人體內(nèi)與糖尿病相關(guān)的DNA序列變化是如何影響它們的?”
應(yīng)激反應(yīng)的基因
Stitzel的研究小組將健康的人類(lèi)胰島細(xì)胞暴露于已知會(huì)引起內(nèi)質(zhì)網(wǎng)應(yīng)激或細(xì)胞因子應(yīng)激的化合物中。然后,他們追蹤細(xì)胞中RNA分子水平的變化,以及細(xì)胞內(nèi)不同DNA片段排列的緊密程度或松散程度——這是細(xì)胞在任何給定時(shí)間使用哪些基因和調(diào)控元件的代理。
為了分析結(jié)果,該團(tuán)隊(duì)與JAX的教授兼計(jì)算生物學(xué)家Ucar合作。科學(xué)家們共同發(fā)現(xiàn),超過(guò)5000個(gè)基因,或健康胰島細(xì)胞表達(dá)的所有基因的近三分之一,在內(nèi)質(zhì)網(wǎng)壓力或細(xì)胞因子壓力下改變了它們的表達(dá)。其中許多參與了蛋白質(zhì)的產(chǎn)生,這對(duì)胰島細(xì)胞產(chǎn)生胰島素至關(guān)重要。大多數(shù)基因只參與一種或另一種應(yīng)激反應(yīng),提出了兩種不同的應(yīng)激途徑在糖尿病中起作用的觀點(diǎn)。
此外,大約八分之一的用于胰島細(xì)胞的DNA調(diào)節(jié)區(qū)域被壓力改變。重要的是,這些調(diào)控區(qū)域中有86個(gè)先前被發(fā)現(xiàn)含有2型糖尿病高危人群的遺傳變異。
Stitzel說(shuō):“這表明,具有這些基因變異的人的胰島細(xì)胞對(duì)壓力的反應(yīng)可能比其他人更差。”“你的環(huán)境——比如糖尿病和肥胖——觸發(fā)了2型糖尿病,但你的基因是扳機(jī)的扳機(jī)。”
Stitzel希望新的調(diào)控區(qū)域和基因列表最終能夠通過(guò)潛在地使胰島細(xì)胞更能適應(yīng)壓力而產(chǎn)生預(yù)防或治療糖尿病的新藥。

圖2 人胰島ER應(yīng)激和細(xì)胞因子反應(yīng)基因的綜合比較圖譜
一個(gè)可用藥的目標(biāo)
研究人員找到了一個(gè)被內(nèi)質(zhì)網(wǎng)應(yīng)激改變的基因。該基因被稱(chēng)為MAP3K5,在胰島素編碼基因中含有引起糖尿病的突變的小鼠中,被證明可以改變胰島β細(xì)胞的死亡。
在這篇新論文中,Stitzel和他的同事們表明,更高水平的MAP3K5導(dǎo)致更多的胰島β細(xì)胞在內(nèi)質(zhì)網(wǎng)應(yīng)激下死亡。另一方面,消除或阻斷MAP3K5使胰島細(xì)胞對(duì)內(nèi)質(zhì)網(wǎng)應(yīng)激更有彈性,更不容易死亡。
針對(duì)MAP3K5的藥物Selonsertib的早期研究表明,它可以降低糖尿病嚴(yán)重并發(fā)癥的風(fēng)險(xiǎn)。新的研究結(jié)果指出了這種藥物的另一個(gè)可能的作用——在糖尿病高危人群中預(yù)防糖尿病,幫助他們的胰島細(xì)胞在細(xì)胞壓力下保持功能和活力。
Stitzel說(shuō):“這種治療方法已經(jīng)在臨床試驗(yàn)中,這確實(shí)令人興奮,但要了解這種藥物是否能夠用于初級(jí)預(yù)防,還需要做更多的工作。”
參考資料
[1] Multi-omic human pancreatic islet endoplasmic reticulum and cytokine stress response mapping provides type 2 diabetes genetic insights



