自《Science》雜志將免疫療法評為十大科學突破之首開始,這一療法就成為諸多腫瘤患者的新希望。近年來,隨著腫瘤免疫學、細胞生物學和分子技術(shù)等研究不斷深入,腫瘤免疫療法進入黃金期,眾多生物制藥公司積極布局腫瘤免疫治療市場,尤其是免疫檢查點抑制劑藥物的獲批上市,使得多種免疫療法百花齊放、百家爭鳴。
T淋巴細胞(T-lymphocyte)作為一種重要的免疫細胞,由于具有監(jiān)視和消滅外來入侵者的能力,因此成為腫瘤免疫療法的核心支柱。但值得注意的是,營養(yǎng)物質(zhì)(如L-精氨酸)的可用性對于T細胞功能和免疫反應至關(guān)重要。然而,腫瘤微環(huán)境缺乏營養(yǎng)的持續(xù)供給卻使T細胞活性受到限制。
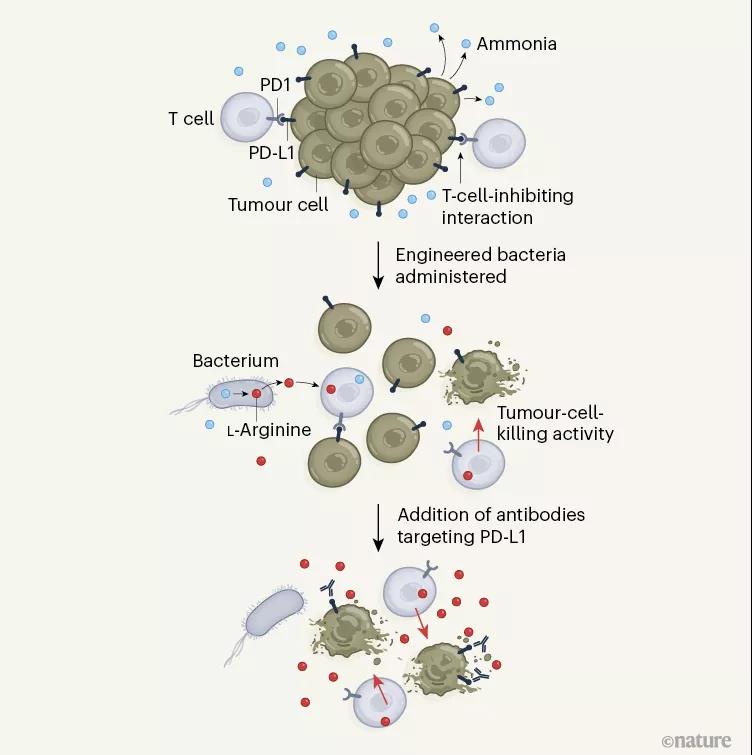
近日,來自美國加州大學科研團隊的一項新研究為這個難題找到了突破口,他們發(fā)現(xiàn)了一種可靶向性定植于癌細胞中的工程益生菌,能變廢為寶,將腫瘤微環(huán)境中的代謝廢物轉(zhuǎn)化為L-精氨酸,從而促進T細胞抗腫瘤免疫應答,為提高臨床T細胞治療效果提供了新的策略和依據(jù)。相關(guān)研究以Metabolic modulation of tumours with engineered bacteria forimmunotherapy為題發(fā)表于期刊《Nature》上。

先前的研究表明,補充L-精氨酸可延長患有黑色素瘤小鼠體內(nèi)T細胞的存活時間,并增強其免疫記憶的生成,提高腫瘤的殺傷性。然而,事實上,在臨床中給患者補充L-精氨酸并不實際,若選擇口服遞送氨基酸,患者每日需服用的劑量超過安全劑量,若選擇瘤內(nèi)注射,也只能將氨基酸注射于皮膚表層附近的腫瘤,且會因藥物滲漏而做無用功。因此亟需尋找出一種可持續(xù)、穩(wěn)定的向腫瘤微環(huán)境中供應L-精氨酸的方式以提升腫瘤免疫療法的療效。
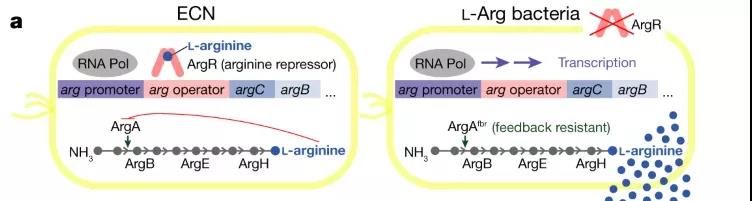
眾所周知,埃希氏大腸桿菌Nissle1917 (ECN) 是德國醫(yī)生Alfred Nissle于1917年從一名抗腹瀉士兵糞便中分離出的一株益生菌,因其具有對人體無害,不產(chǎn)生分泌毒素,也無持久的使血紅素粘連的特點,現(xiàn)如今被廣泛應用于遞送,釋放和腫瘤治療等醫(yī)療用途。
在這項新的研究中,科研人員對ECN進行了基因改造,刪除了精氨酸抑制基因 ( ArgR ),并整合了不受負反饋調(diào)節(jié)抑制的ArgA fbr突變,構(gòu)建了一種工程益生菌L - Arg細菌,它能特異性地在腫瘤中定植,將腫瘤中積累的代謝廢物氨轉(zhuǎn)化為L-精氨酸。
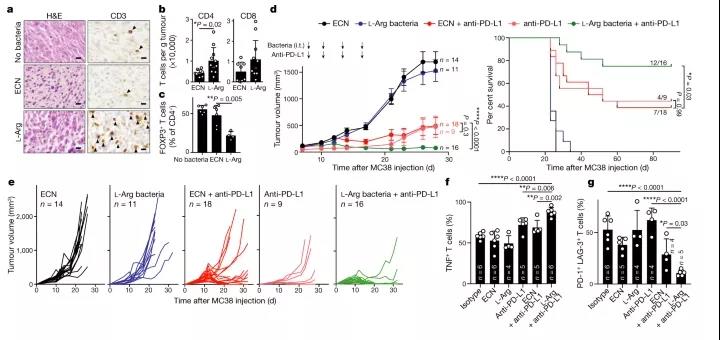
在進一步的試驗中,研究人員使用L - Arg細菌對患有結(jié)腸癌(MC38)的C57BL/6小鼠通過瘤內(nèi)注射方式給藥,研究發(fā)現(xiàn),L -Arg 細菌能提高腫瘤內(nèi)L-精氨酸濃度,增加腫瘤浸潤的T細胞的數(shù)量、促進效應T細胞功能。此外,L-Arg 細菌與 PD-L1 靶向抗體聯(lián)合使用能將抗PD-L1治療效果提升近30%,限制小鼠的腫瘤生長,試驗中74%接受聯(lián)合療法治療的小鼠的腫瘤被可根除。
不僅如此,研究作者在黑色素瘤小鼠模型(B16-OVA)中也觀察到了相似的結(jié)果。更重要的是,當在腫瘤消退的小鼠體內(nèi)再次接種MC38 細胞后,腫瘤并沒有生長,這說明小鼠體內(nèi)已經(jīng)形成了長期免疫。
總而言之,該開創(chuàng)性研究成果為利用細菌調(diào)節(jié)腫瘤微環(huán)境提供了實質(zhì)性支持,且該成果具有臨床轉(zhuǎn)化的潛力。但值得注意的是,盡管在患癌小鼠體內(nèi)注射L- Arg 細菌后,并未產(chǎn)生顯著的毒副作用,但其對人體的有效性和安全性仍需進一步探究,未來,將會把這項臨床成果應用于臨床試驗,以更廣泛的探索其安全性和可靠性。



