癌癥作為威脅人類健康的"頭號(hào)殺手",癌細(xì)胞是一類生命力極為頑強(qiáng)的細(xì)胞,它們通過(guò)分泌細(xì)胞因子來(lái)逃避機(jī)體免疫系統(tǒng)的追捕,它們通過(guò)不斷增殖和擴(kuò)散來(lái)擴(kuò)展生存空間,它們通過(guò)不斷變異來(lái)產(chǎn)生異質(zhì)性以免被一網(wǎng)打盡。這些特征使得癌癥成為了難治愈的疾病之一。
迄今為止,由于無(wú)法穿透實(shí)體腫瘤細(xì)胞膜,無(wú)法有效地靶向關(guān)鍵的癌癥通路。當(dāng)前的遞送方法,例如納米顆粒、細(xì)胞穿透肽和抗體藥物偶聯(lián)物,由于進(jìn)入細(xì)胞的能力差、無(wú)法特異性靶向癌細(xì)胞以及容易被細(xì)胞對(duì)外來(lái)入侵者的天然保護(hù)而降解,因此功效有限。
2021年10月21日,美國(guó)馬薩諸塞大學(xué)聯(lián)合比利時(shí)魯汶大學(xué)的研究人員在 Nature 子刊" Nature Communications "期刊發(fā)表了一篇題為" Intracellular delivery of protein drugs with an autonomously lysing bacterial system reduces tumor growth and metastases"的研究論文。
該研究開(kāi)發(fā)了一種無(wú)毒、基于細(xì)菌的遞送系統(tǒng),沙門氏菌,它不僅可以輕松進(jìn)入細(xì)胞,而且可以專門針對(duì)癌細(xì)胞直接輸送蛋白質(zhì)(藥物),且不影響健康細(xì)胞。一旦它的蛋白質(zhì)有效載荷被傳遞,細(xì)菌就會(huì)清除,可以為目前無(wú)法治療的癌癥,如肝癌或轉(zhuǎn)移性乳腺癌提供有效的靶向治療。

該遞送系統(tǒng)使用一種高度改良的沙門氏菌,菌株利用三個(gè)基因回路,能夠精確控制藥物生產(chǎn)、細(xì)胞侵襲和蛋白質(zhì)釋放,這種利用沙門氏菌的天然入侵和生存機(jī)制可以使蛋白質(zhì)有效載荷直接自主沉積到癌細(xì)胞中。
早期的研究表明,沙門氏菌會(huì)在腫瘤中積聚,但不知道它們會(huì)侵入癌細(xì)胞。研究人員給小鼠注射細(xì)菌,使用熒光技術(shù)準(zhǔn)確測(cè)量這種細(xì)胞滲透,研究發(fā)現(xiàn),70%的沙門氏菌能浸入癌細(xì)胞內(nèi)部。
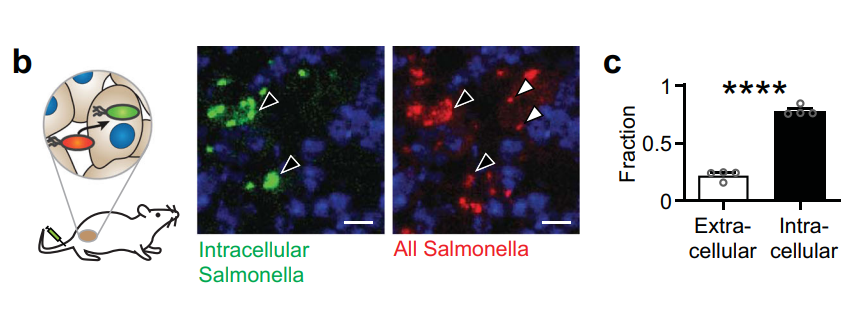
(圖注:70%的沙門氏菌能浸入癌細(xì)胞內(nèi)部)
在細(xì)菌浸入癌細(xì)胞后,當(dāng)沙門氏菌裂解時(shí),有效載荷蛋白被釋放到癌細(xì)胞中,隨著時(shí)間的推移,蛋白質(zhì)分散到細(xì)胞質(zhì)中,在那里它可以與其目標(biāo)相互作用。
在小鼠模型中,研究人員測(cè)試了肝癌和三陰性乳腺癌。
在乳腺癌中,治療14天后,小鼠的乳腺腫瘤體積比對(duì)照組減少了兩倍,并且阻止了肺中已建立的轉(zhuǎn)移灶的生長(zhǎng)。
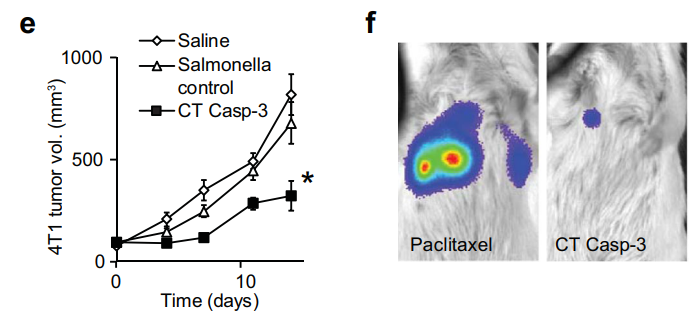
(圖注:乳腺癌治療)
在兩種肝癌模型中(BNL-MEA和Hepa),靜脈注射沙門氏菌載體,使兩種肝癌腫瘤的生長(zhǎng)減少了47%和57%,治療50天后,未觀察到毒性作用。并且消除了一只小鼠的腫瘤,該小鼠在300多天內(nèi)保持無(wú)病狀態(tài)。
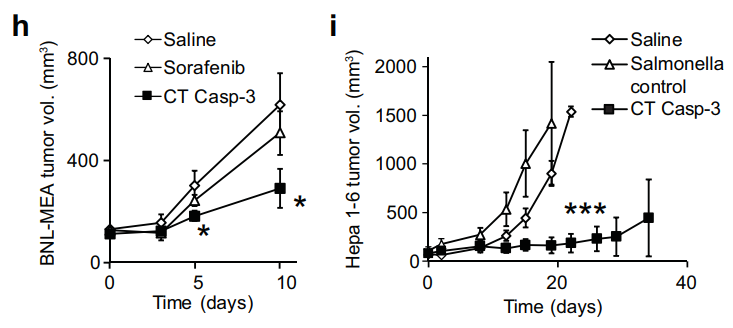
(圖注:肝癌治療)
目前每年有84萬(wàn)名被診斷為不可切除的肝細(xì)胞癌的患者,目前尚無(wú)治愈性治療方法,只能適度提高生存率。用沙門氏菌治療可能更安全、更有效。注射后7天,沙門氏菌從大多數(shù)器官中清除。此外,在健康組織中未檢測(cè)到遞送的蛋白質(zhì),并且未觀察到毒性。
在轉(zhuǎn)移性乳腺癌模型中的功效表明沙門氏菌減少了腫瘤生長(zhǎng)并阻止了轉(zhuǎn)移,可用于治療晚期疾病。
總之,結(jié)果表明,這種基于沙門氏菌的遞送平臺(tái)是一種有效的癌癥療法,可以為目前無(wú)法治療的癌癥,如肝癌或轉(zhuǎn)移性乳腺癌提供有效的靶向治療,并提高了癌癥治療的有效性和安全性。
參考資料:
癌癥作為威脅人類健康的"頭號(hào)殺手",癌細(xì)胞是一類生命力極為頑強(qiáng)的細(xì)胞,它們通過(guò)分泌細(xì)胞因子來(lái)逃避機(jī)體免疫系統(tǒng)的追捕,它們通過(guò)不斷增殖和擴(kuò)散來(lái)擴(kuò)展生存空間,它們通過(guò)不斷變異來(lái)產(chǎn)生異質(zhì)性以免被一網(wǎng)打盡。這些特征使得癌癥成為了難治愈的疾病之一。
迄今為止,由于無(wú)法穿透實(shí)體腫瘤細(xì)胞膜,無(wú)法有效地靶向關(guān)鍵的癌癥通路。當(dāng)前的遞送方法,例如納米顆粒、細(xì)胞穿透肽和抗體藥物偶聯(lián)物,由于進(jìn)入細(xì)胞的能力差、無(wú)法特異性靶向癌細(xì)胞以及容易被細(xì)胞對(duì)外來(lái)入侵者的天然保護(hù)而降解,因此功效有限。
2021年10月21日,美國(guó)馬薩諸塞大學(xué)聯(lián)合比利時(shí)魯汶大學(xué)的研究人員在 Nature 子刊" Nature Communications "期刊發(fā)表了一篇題為" Intracellular delivery of protein drugs with an autonomously lysing bacterial system reduces tumor growth and metastases"的研究論文。
該研究開(kāi)發(fā)了一種無(wú)毒、基于細(xì)菌的遞送系統(tǒng),沙門氏菌,它不僅可以輕松進(jìn)入細(xì)胞,而且可以專門針對(duì)癌細(xì)胞直接輸送蛋白質(zhì)(藥物),且不影響健康細(xì)胞。一旦它的蛋白質(zhì)有效載荷被傳遞,細(xì)菌就會(huì)清除,可以為目前無(wú)法治療的癌癥,如肝癌或轉(zhuǎn)移性乳腺癌提供有效的靶向治療。

該遞送系統(tǒng)使用一種高度改良的沙門氏菌,菌株利用三個(gè)基因回路,能夠精確控制藥物生產(chǎn)、細(xì)胞侵襲和蛋白質(zhì)釋放,這種利用沙門氏菌的天然入侵和生存機(jī)制可以使蛋白質(zhì)有效載荷直接自主沉積到癌細(xì)胞中。
早期的研究表明,沙門氏菌會(huì)在腫瘤中積聚,但不知道它們會(huì)侵入癌細(xì)胞。研究人員給小鼠注射細(xì)菌,使用熒光技術(shù)準(zhǔn)確測(cè)量這種細(xì)胞滲透,研究發(fā)現(xiàn),70%的沙門氏菌能浸入癌細(xì)胞內(nèi)部。

(圖注:70%的沙門氏菌能浸入癌細(xì)胞內(nèi)部)
在細(xì)菌浸入癌細(xì)胞后,當(dāng)沙門氏菌裂解時(shí),有效載荷蛋白被釋放到癌細(xì)胞中,隨著時(shí)間的推移,蛋白質(zhì)分散到細(xì)胞質(zhì)中,在那里它可以與其目標(biāo)相互作用。
在小鼠模型中,研究人員測(cè)試了肝癌和三陰性乳腺癌。
在乳腺癌中,治療14天后,小鼠的乳腺腫瘤體積比對(duì)照組減少了兩倍,并且阻止了肺中已建立的轉(zhuǎn)移灶的生長(zhǎng)。

(圖注:乳腺癌治療)
在兩種肝癌模型中(BNL-MEA和Hepa),靜脈注射沙門氏菌載體,使兩種肝癌腫瘤的生長(zhǎng)減少了47%和57%,治療50天后,未觀察到毒性作用。并且消除了一只小鼠的腫瘤,該小鼠在300多天內(nèi)保持無(wú)病狀態(tài)。

(圖注:肝癌治療)
目前每年有84萬(wàn)名被診斷為不可切除的肝細(xì)胞癌的患者,目前尚無(wú)治愈性治療方法,只能適度提高生存率。用沙門氏菌治療可能更安全、更有效。注射后7天,沙門氏菌從大多數(shù)器官中清除。此外,在健康組織中未檢測(cè)到遞送的蛋白質(zhì),并且未觀察到毒性。
在轉(zhuǎn)移性乳腺癌模型中的功效表明沙門氏菌減少了腫瘤生長(zhǎng)并阻止了轉(zhuǎn)移,可用于治療晚期疾病。
總之,結(jié)果表明,這種基于沙門氏菌的遞送平臺(tái)是一種有效的癌癥療法,可以為目前無(wú)法治療的癌癥,如肝癌或轉(zhuǎn)移性乳腺癌提供有效的靶向治療,并提高了癌癥治療的有效性和安全性。
參考資料:



