研究人員已經(jīng)確定了癌癥進(jìn)化中一個(gè)以前未被認(rèn)識(shí)到的關(guān)鍵角色:發(fā)生在基因組特定區(qū)域的突變簇。這些突變簇有助于約10%的人類癌癥的進(jìn)展,并可用于預(yù)測患者的生存率。
該研究結(jié)果發(fā)表在2月9日出版的《Nature》雜志上。
這項(xiàng)研究揭示了一類被稱為聚集體細(xì)胞突變的突變——聚集意味著它們在細(xì)胞基因組的特定區(qū)域聚集在一起,而體細(xì)胞意味著它們不是遺傳的,而是由內(nèi)部和外部因素引起的,比如衰老或暴露在紫外線輻射下。
到目前為止,聚集的體細(xì)胞突變一直是癌癥發(fā)展中一個(gè)有待研究的領(lǐng)域。但加州大學(xué)圣地亞哥分校生物工程、細(xì)胞和分子醫(yī)學(xué)教授Ludmil Alexandrov實(shí)驗(yàn)室的研究人員發(fā)現(xiàn),這些突變非常不尋常,值得進(jìn)一步研究。
“我們通常會(huì)看到基因組中隨機(jī)發(fā)生的體細(xì)胞突變。但當(dāng)我們仔細(xì)觀察這些突變時(shí),我們發(fā)現(xiàn)它們發(fā)生在這些熱點(diǎn)地區(qū)。這就像在地上扔球,然后突然看到它們聚集在一個(gè)空間,”Alexandrov說。“所以我們不禁想知道:這里發(fā)生了什么?為什么會(huì)有熱點(diǎn)?它們與臨床相關(guān)嗎?它們能告訴我們癌癥是如何發(fā)展的嗎?”
Alexandrov實(shí)驗(yàn)室的生物工程博士生、該研究的第一作者Erik Bergstrom說:“聚集性突變在很大程度上被忽視了,因?yàn)樗鼈冎徽妓型蛔兊暮苄∫徊糠帧5ㄟ^深入研究,我們發(fā)現(xiàn)它們在人類癌癥的病因?qū)W中發(fā)揮著重要作用。”
聚集體細(xì)胞突變
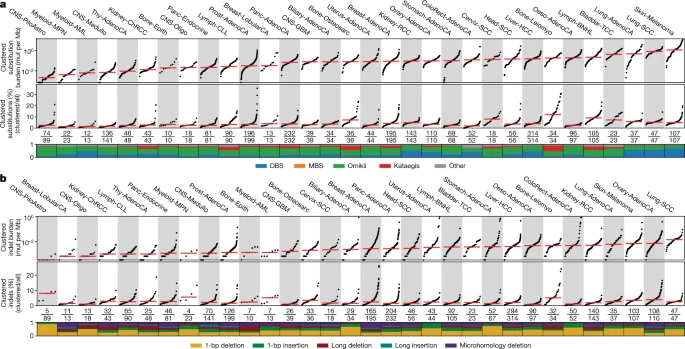
該團(tuán)隊(duì)的發(fā)現(xiàn)是通過創(chuàng)建全面和詳細(xì)的已知聚集體細(xì)胞突變的地圖而實(shí)現(xiàn)的。他們首先繪制了2500多名癌癥患者基因組中的所有突變(聚集突變和非聚集突變),這項(xiàng)工作總共包含了30種不同的癌癥類型。研究人員使用亞歷山德羅夫?qū)嶒?yàn)室開發(fā)的下一代人工智能方法繪制了他們的地圖。該團(tuán)隊(duì)使用這些算法來檢測個(gè)體患者中的聚集突變,并闡明導(dǎo)致這些事件的潛在突變過程。他們發(fā)現(xiàn),在大約10%的人類癌癥中,聚集的體細(xì)胞突變有助于癌癥的進(jìn)化。
更進(jìn)一步,研究人員還發(fā)現(xiàn),一些癌癥驅(qū)動(dòng)簇——特別是那些在已知的癌癥驅(qū)動(dòng)基因中發(fā)現(xiàn)的——可以用來預(yù)測患者的總體生存率。例如,BRAF基因(黑色素瘤中廣泛觀察的驅(qū)動(dòng)基因)的聚集突變的存在,比非聚集突變的個(gè)體帶來更好的總體患者生存。同時(shí),EGFR基因(肺癌中廣泛觀察的驅(qū)動(dòng)基因)的聚集突變的存在導(dǎo)致患者生存期的下降。
“重要的是,我們看到僅從這些基因中檢測到的聚集突變就能產(chǎn)生不同的生存率,這是可以用臨床常用的現(xiàn)有平臺(tái)檢測到的。因此,這是一個(gè)非常簡單和精確的患者生存生物標(biāo)記。”
“這項(xiàng)出色的工作強(qiáng)調(diào)了開發(fā)人工智能方法來闡明腫瘤生物學(xué)的重要性,以及使用可直接轉(zhuǎn)化為臨床視線的標(biāo)準(zhǔn)平臺(tái)來發(fā)現(xiàn)和快速開發(fā)生物標(biāo)志物的重要性。”摩爾斯癌癥中心主任、加州大學(xué)圣地亞哥分校癌癥研究和護(hù)理副校長Scott Lippman說。“這凸顯了加州大學(xué)圣地亞哥分校在結(jié)合工程方法和人工智能解決當(dāng)前癌癥醫(yī)學(xué)問題方面的優(yōu)勢。”
癌癥進(jìn)化的新模式
在這項(xiàng)研究中,研究人員還確定了導(dǎo)致聚集性體細(xì)胞突變的各種因素。這些因素包括紫外線輻射、飲酒、吸煙,值得注意的是,一種叫做APOBEC3的抗病毒酶的活性。
APOBEC3酶通常存在于細(xì)胞內(nèi)部,作為細(xì)胞內(nèi)部免疫反應(yīng)的一部分。它們的主要工作是切斷任何進(jìn)入細(xì)胞的病毒。但在癌細(xì)胞中,研究人員認(rèn)為APOBEC3酶可能弊大于利。
研究人員發(fā)現(xiàn),癌細(xì)胞中通常充滿了攜帶著已知癌癥驅(qū)動(dòng)基因的染色體外DNA (ecDNA)環(huán)狀結(jié)構(gòu),在單個(gè)ecDNA分子中存在著聚集的突變。研究人員將這些突變歸因于APOBEC3酶的活性。他們假設(shè)APOBEC3酶誤將外鏈DNA的環(huán)當(dāng)成外來病毒,并試圖限制和切斷它們。在此過程中,APOBEC3酶導(dǎo)致單個(gè)ecDNA分子內(nèi)形成突變簇。這反過來又在加速癌癥進(jìn)化和可能導(dǎo)致耐藥性方面發(fā)揮了關(guān)鍵作用。研究人員將這些聚集的突變環(huán)命名為kyklonas,這是希臘語中氣旋的意思。
Alexandrov說:“這是一種全新的腫瘤發(fā)生模式。”他解釋說,隨著團(tuán)隊(duì)的其他發(fā)現(xiàn),“這為新的治療方法奠定了基礎(chǔ),臨床醫(yī)生可以考慮限制APOBEC3酶的活性和/或針對染色體外DNA的癌癥治療。”
參考資料:
研究人員已經(jīng)確定了癌癥進(jìn)化中一個(gè)以前未被認(rèn)識(shí)到的關(guān)鍵角色:發(fā)生在基因組特定區(qū)域的突變簇。這些突變簇有助于約10%的人類癌癥的進(jìn)展,并可用于預(yù)測患者的生存率。
該研究結(jié)果發(fā)表在2月9日出版的《Nature》雜志上。
這項(xiàng)研究揭示了一類被稱為聚集體細(xì)胞突變的突變——聚集意味著它們在細(xì)胞基因組的特定區(qū)域聚集在一起,而體細(xì)胞意味著它們不是遺傳的,而是由內(nèi)部和外部因素引起的,比如衰老或暴露在紫外線輻射下。
到目前為止,聚集的體細(xì)胞突變一直是癌癥發(fā)展中一個(gè)有待研究的領(lǐng)域。但加州大學(xué)圣地亞哥分校生物工程、細(xì)胞和分子醫(yī)學(xué)教授Ludmil Alexandrov實(shí)驗(yàn)室的研究人員發(fā)現(xiàn),這些突變非常不尋常,值得進(jìn)一步研究。
“我們通常會(huì)看到基因組中隨機(jī)發(fā)生的體細(xì)胞突變。但當(dāng)我們仔細(xì)觀察這些突變時(shí),我們發(fā)現(xiàn)它們發(fā)生在這些熱點(diǎn)地區(qū)。這就像在地上扔球,然后突然看到它們聚集在一個(gè)空間,”Alexandrov說。“所以我們不禁想知道:這里發(fā)生了什么?為什么會(huì)有熱點(diǎn)?它們與臨床相關(guān)嗎?它們能告訴我們癌癥是如何發(fā)展的嗎?”
Alexandrov實(shí)驗(yàn)室的生物工程博士生、該研究的第一作者Erik Bergstrom說:“聚集性突變在很大程度上被忽視了,因?yàn)樗鼈冎徽妓型蛔兊暮苄∫徊糠帧5ㄟ^深入研究,我們發(fā)現(xiàn)它們在人類癌癥的病因?qū)W中發(fā)揮著重要作用。”

聚集體細(xì)胞突變
該團(tuán)隊(duì)的發(fā)現(xiàn)是通過創(chuàng)建全面和詳細(xì)的已知聚集體細(xì)胞突變的地圖而實(shí)現(xiàn)的。他們首先繪制了2500多名癌癥患者基因組中的所有突變(聚集突變和非聚集突變),這項(xiàng)工作總共包含了30種不同的癌癥類型。研究人員使用亞歷山德羅夫?qū)嶒?yàn)室開發(fā)的下一代人工智能方法繪制了他們的地圖。該團(tuán)隊(duì)使用這些算法來檢測個(gè)體患者中的聚集突變,并闡明導(dǎo)致這些事件的潛在突變過程。他們發(fā)現(xiàn),在大約10%的人類癌癥中,聚集的體細(xì)胞突變有助于癌癥的進(jìn)化。
更進(jìn)一步,研究人員還發(fā)現(xiàn),一些癌癥驅(qū)動(dòng)簇——特別是那些在已知的癌癥驅(qū)動(dòng)基因中發(fā)現(xiàn)的——可以用來預(yù)測患者的總體生存率。例如,BRAF基因(黑色素瘤中廣泛觀察的驅(qū)動(dòng)基因)的聚集突變的存在,比非聚集突變的個(gè)體帶來更好的總體患者生存。同時(shí),EGFR基因(肺癌中廣泛觀察的驅(qū)動(dòng)基因)的聚集突變的存在導(dǎo)致患者生存期的下降。
“重要的是,我們看到僅從這些基因中檢測到的聚集突變就能產(chǎn)生不同的生存率,這是可以用臨床常用的現(xiàn)有平臺(tái)檢測到的。因此,這是一個(gè)非常簡單和精確的患者生存生物標(biāo)記。”
“這項(xiàng)出色的工作強(qiáng)調(diào)了開發(fā)人工智能方法來闡明腫瘤生物學(xué)的重要性,以及使用可直接轉(zhuǎn)化為臨床視線的標(biāo)準(zhǔn)平臺(tái)來發(fā)現(xiàn)和快速開發(fā)生物標(biāo)志物的重要性。”摩爾斯癌癥中心主任、加州大學(xué)圣地亞哥分校癌癥研究和護(hù)理副校長Scott Lippman說。“這凸顯了加州大學(xué)圣地亞哥分校在結(jié)合工程方法和人工智能解決當(dāng)前癌癥醫(yī)學(xué)問題方面的優(yōu)勢。”
癌癥進(jìn)化的新模式
在這項(xiàng)研究中,研究人員還確定了導(dǎo)致聚集性體細(xì)胞突變的各種因素。這些因素包括紫外線輻射、飲酒、吸煙,值得注意的是,一種叫做APOBEC3的抗病毒酶的活性。
APOBEC3酶通常存在于細(xì)胞內(nèi)部,作為細(xì)胞內(nèi)部免疫反應(yīng)的一部分。它們的主要工作是切斷任何進(jìn)入細(xì)胞的病毒。但在癌細(xì)胞中,研究人員認(rèn)為APOBEC3酶可能弊大于利。
研究人員發(fā)現(xiàn),癌細(xì)胞中通常充滿了攜帶著已知癌癥驅(qū)動(dòng)基因的染色體外DNA (ecDNA)環(huán)狀結(jié)構(gòu),在單個(gè)ecDNA分子中存在著聚集的突變。研究人員將這些突變歸因于APOBEC3酶的活性。他們假設(shè)APOBEC3酶誤將外鏈DNA的環(huán)當(dāng)成外來病毒,并試圖限制和切斷它們。在此過程中,APOBEC3酶導(dǎo)致單個(gè)ecDNA分子內(nèi)形成突變簇。這反過來又在加速癌癥進(jìn)化和可能導(dǎo)致耐藥性方面發(fā)揮了關(guān)鍵作用。研究人員將這些聚集的突變環(huán)命名為kyklonas,這是希臘語中氣旋的意思。
Alexandrov說:“這是一種全新的腫瘤發(fā)生模式。”他解釋說,隨著團(tuán)隊(duì)的其他發(fā)現(xiàn),“這為新的治療方法奠定了基礎(chǔ),臨床醫(yī)生可以考慮限制APOBEC3酶的活性和/或針對染色體外DNA的癌癥治療。”
參考資料:



