溶瘤病毒是一類具有復制能力的腫瘤殺傷性病毒,由于其能夠刺激機體產生抗癌的免疫反應而不會傷害正常的健康組織,逐漸成為抗腫瘤治療領域的新星。
20世紀初,《The Lancet》雜志報道了一位患有慢性白血病的婦女在一次流感病毒感染后,出現了病變白細胞數減少、病情好轉的跡象,因此吸引了科學界的目光。1991年,《Science》雜志的一篇文章正式拉開了溶瘤病毒進軍抗癌圈的序幕,人類首次對溶瘤病毒進行基因改造,將其用于惡性神經膠質瘤。
然而這把“抗腫瘤利劍”的誕生之路并非一帆風順,2005年,世界第一款抗癌溶瘤病毒“H101(安柯瑞)“在中國上市,但治癌效果卻不如人意,隨后便逐漸“隱退江湖”,直到2015年FDA批準美國首個治療黑色素瘤的溶瘤病毒療法,才正式開啟了溶瘤病毒的抗癌之路。
但溶瘤病毒療法也存在缺陷,當該療法獨立使用時并不能使腫瘤都消退,究其根本,主要是由于每個癌癥患者對溶瘤病毒的敏感性和反應程度不同,因此,為了能讓癌癥患者在該療法中受益,有效的識別出易受病毒感染宿主的遺傳特征成為目前研究的重中之重。
近日,德國癌癥研究中心與溶瘤病毒免疫治療實驗室的科研人員聯合在《Nature Communications》雜志發表了一篇題為Oncolytic H-1 parvovirus binds to sialic acid on laminins for cell attachment and entry的文章,該研究找到了病毒進入癌細胞的大門“層粘連蛋白”,并闡明了H-1細小病毒(H-1PV)是如何附著并偷襲癌細胞使腫瘤裂解和死亡的。

https://doi.org/10.1038/s41467-021-24034-7
為了更有效的利用溶瘤病毒,找到有助于識別H-1PV易感性的生物標志物,研究團隊分析了位于癌細胞表面的蛋白質基因,以表征它們在與病毒對接過程的作用。
一種在介導細胞附著和滲透中起關鍵作用的調節劑“層粘連蛋白γ1” ( LAMC1 )被鎖定,從本質上講,當病毒與癌細胞的特定部分相互作用時,癌細胞表面的層粘連蛋白就像一扇“門”,它能夠幫助病毒追蹤、附著并瓦解癌細胞。研究發現,當LAMC1在神經膠質瘤、宮頸癌、胰腺癌、結直腸癌和肺癌等環境下失活時,病毒對癌細胞的攻擊性會減弱。
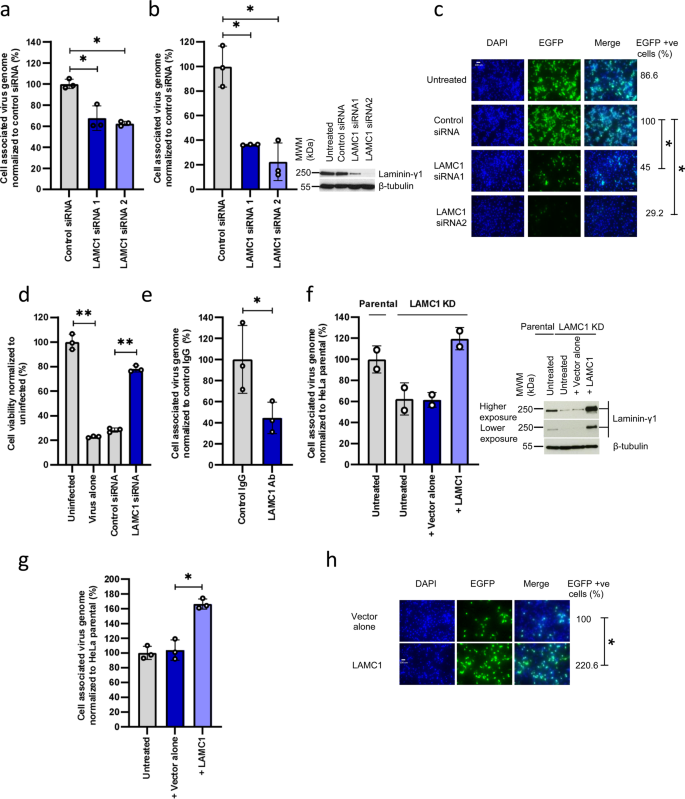
層粘連蛋白 γ1 參與 H-1PV 細胞的附著和進入
在進一步的研究中,科研人員評估了這項新發現的臨床意義。研究人員指出,層粘連蛋白會在不同的腫瘤微環境中差異表達,例如與健康組織相比,它會在胰腺癌和膠質母細胞瘤 (GBM)中過度表達。
此外,在腦腫瘤中,它的表達量會隨腫瘤級別的增加而增加,晚期 GBM患者腫瘤中的層粘連蛋白水平要更高一些。不僅如此,110 份原發性和復發性 GBM 的活檢分析報告顯示,與原發性腫瘤相比,復發性GBM中層粘連蛋白的水平明顯更高。
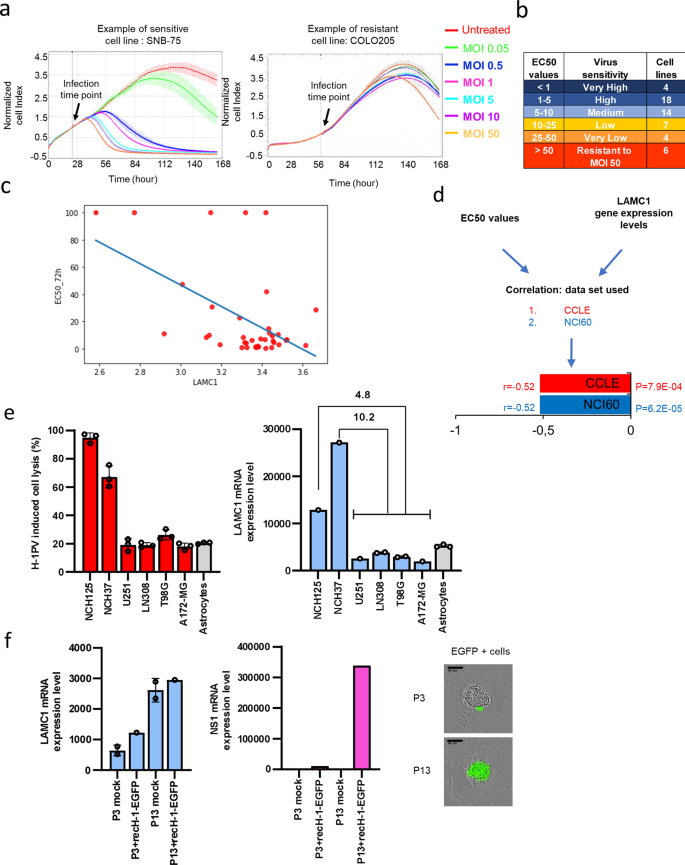
癌細胞系對 H-1PV 溶瘤的敏感性與LAMC1表達水平直接相關
然而令人欣慰的是,盡管層粘連蛋白表達量的升高與多種腫瘤患者預后和生存不良相關,但卻能使腫瘤更容易被感染和破壞,也就是說,層粘連蛋白表達量高的癌癥患者更有可能對溶瘤病毒療法產生反應。
因此,未來我們可以將層粘連蛋白作為一種生物標志物,依據其表達水平對癌癥患者進行分類,以便于預測不同類型的癌癥對基于H-1PV的抗癌療法的敏感性和反應性。
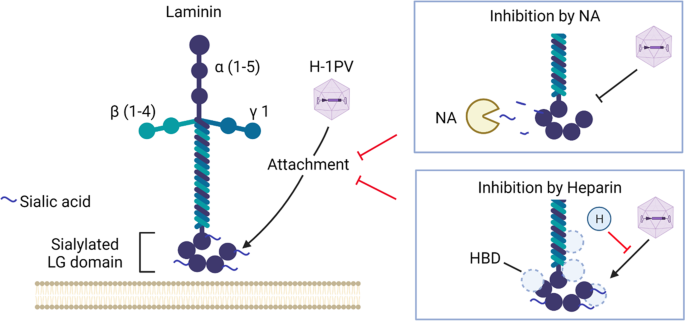
層粘連蛋白和 H-1PV 之間相互作用
近年來,各大制藥公司都紛紛布局溶瘤病毒,而這項新的研究將助于科研人員進行臨床試驗的設計,降低研發成本、縮短審批新藥時間,切實改善癌癥患者的治療效果,因此或能成為未來治癌領域的“明日之星”。



