摘要:腦損傷的干細胞治療一個關(guān)鍵是待治療部位缺少血液輸送氧氣維持移植細胞代謝。墨爾本大學開發(fā)了一種添加血紅蛋白的水凝膠能夠讓干細胞存活足夠長的時間維持恰好的氧水平,動物實驗表明新凝膠能顯著提高小鼠的腦損傷部位的移植干細胞生存分化。
墨爾本大學和澳大利亞國立大學的研究人員開發(fā)了一種新的“混合”水凝膠,可以讓臨床醫(yī)生安全地將干細胞輸送到小鼠的腦損傷部位,文章發(fā)表在《Nature Communications》。這一概念驗證突破解決了干細胞研究人員自20世紀80年代以來面臨的一個重大挑戰(zhàn)——讓干細胞存活足夠長的時間,使它們能夠在被注入身體受損部位后能分化生成新組織所需的細胞。

圖1 研究人員開發(fā)了新的水凝膠可以安全地將干細胞輸送到小鼠的腦損傷部位
水凝膠是一種水基凝膠,可用于將物質(zhì)輸送到體內(nèi),并可用于促進新細胞的有效生長。文章中這種新型的水凝膠能為干細胞提供氧氣,以保持干細胞在注射過程中存活,并確保干細胞分化成創(chuàng)造新組織以修復損傷所需的細胞類型。研究人員認為,這一進展將有利于包括大腦和中樞神經(jīng)系統(tǒng)在內(nèi)的身體許多部位的干細胞治療。
用于遞送、支持和整合干細胞的可注射生物材料在組織再生方面具有重要前景,因為它們可以快速有效地填充待治療部位的空隙,以確保良好的組織接觸。在調(diào)整這些材料的物理化學性質(zhì)以適應(yīng)基于附著的細胞所需要的參數(shù)方面,已經(jīng)取得了重大進展。但是由于注射部位一般缺乏血管化,移植細胞依賴于通過組織擴散到移植物部位的氧氣生存。這對于需要不斷進行代謝的活細胞來說是一個顯著限制,尤其是當它們在自然血管生成機制開始之前的重要早期階段迫切需要氧氣持時,這顯著限制了任何修復大范圍缺損的嘗試。事實上,已有研究表明,在缺氧或缺血環(huán)境中,神經(jīng)元存活率降低。然而,這一技術(shù)挑戰(zhàn)非常重大,因為雖然低氧水平(低于2%)可導致細胞死亡,但顯然高氧水平也可能誘導破壞性效應(yīng)。除了呼吸和能量產(chǎn)生需要氧氣之外,氧氣還是定義細胞命運的過程(如中樞神經(jīng)系統(tǒng)[CNS]細胞前體細胞的凋亡和分化)的重要信號分子。據(jù)了解,腦內(nèi)氧化應(yīng)激的主要促發(fā)因素是細胞內(nèi)活性氧(ROS)水平升高,而ROS已被證明可促進少突膠質(zhì)細胞和其他CNS衍生物的凋亡。理想范圍內(nèi)的氧穩(wěn)態(tài)水平對神經(jīng)元祖細胞的生存、增殖和分化至關(guān)重要。
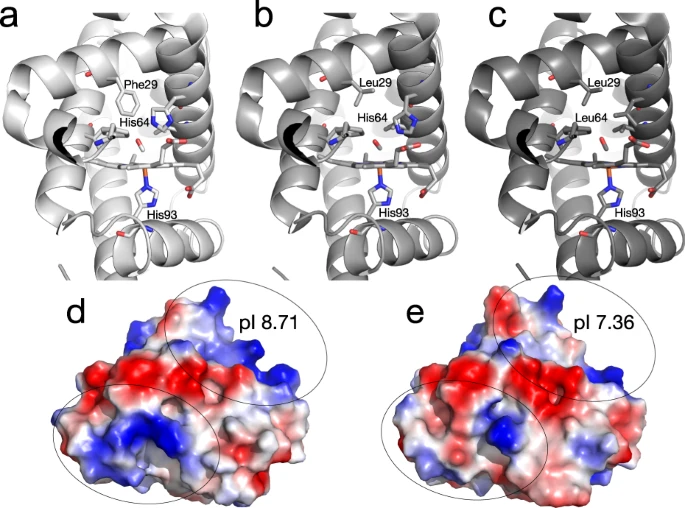
圖2 本研究中檢測了不同的肌紅蛋白變體
在體外和體內(nèi)實驗中,釋氧生物材料已成為新型工程組織中細胞代謝的非血管支持的新方式。大部分注意力都集中在使用過氧化氫(H2O2)來控制和延長氧氣輸送,但H2O2的存在可能導致自由基的產(chǎn)生增加,盡管這可以在一定程度上通過在多組分系統(tǒng)中摻入酶(如過氧化氫酶)來克服。氟化化合物,特別是全氟化碳(pfc),由于其具有生物惰性且易于溶解氧氣,已被探索用作生物材料中的釋氧佐劑。盡管PFC功能化生物材料具有潛力,但它們無法在血管化之前的時間內(nèi)維持氧水平是一個顯著的缺陷。另一種方法是利用天然存在的氧結(jié)合蛋白,如肌紅蛋白(Mb),將氧直接運輸?shù)浇M織。Mb已被用于在軟骨組織工程過程中刺激干細胞的氧合。這一解決方案為臨床可轉(zhuǎn)化的治療提供了更有前景的途徑,因為Mb可促進氧氣沿氧分壓梯度運輸,從而充當氧氣儲存庫。Mb在高氧濃度下通過輔基血紅素有效結(jié)合氧氣(形成氧合肌紅蛋白),并在低氧條件下釋放氧氣(產(chǎn)生脫氧肌紅蛋白),例如代謝活動增加期間的情況。雖然蛋白(如Mb)在改善細胞移植結(jié)局方面具有顯著潛力,但不能簡單地將其注射到干細胞移植物的特定部位來影響細胞命運,因為它們會迅速降解并彌散離開病灶部位,而需要連續(xù)輸入。
研究人員于是嘗試在一種已被證實具有干細胞輸送能力的水凝膠中加入肌紅蛋白來結(jié)合和釋放氧氣。經(jīng)過五年的研究,研究小組發(fā)現(xiàn),一種基于肌紅蛋白的合成蛋白質(zhì)——在抹香鯨和馬的心肌中高濃度存在的一種天然蛋白質(zhì)——添加到水凝膠中,提供了確保干細胞在輸送過程中存活下來并發(fā)育成修復腦組織所需的細胞類型所需的持續(xù)氧氣釋放。鯨魚和其他深潛動物被認為在它們的肌肉組織中進化出了高濃度的肌紅蛋白,這樣它們就可以在潛水時慢慢地吸收盡可能多的氧氣。同樣,馬被認為進化出了更高濃度的肌紅蛋白,因此它們可以跑更遠的距離。
小鼠實驗結(jié)果表明新型水凝膠應(yīng)用于移植物部位時,可以顯著提高CNS內(nèi)干細胞移植技術(shù)的療效,促進移植的皮質(zhì)神經(jīng)干細胞在腦內(nèi)的長期存活和整合。這些結(jié)果是在遭受醫(yī)源性損傷的破壞腦組織中取得的。體內(nèi)移植后28天的組織學分析顯示,與無Mb水凝膠相比,移植的神經(jīng)干細胞存活率顯著提高,并向成熟神經(jīng)元分化。研究人員觀察到Mb存在時內(nèi)源性組織的廣泛神經(jīng)支配,這首次證明了在功能性水凝膠中結(jié)合生物吸入氧輸送,對協(xié)同促進干細胞移植的長期存活和整合具有重要意義。最后,通過使用不同氧親和力的Mb突變體,他們證明了氧釋放與功能整合相關(guān),為實驗觀察提供了分子解釋。這代表了一種開發(fā)組織模擬、易于注射的納米材料的普遍策略,具有多種應(yīng)用,包括在細胞移植、基因和藥物遞送、3D體外疾病模型和芯片器官技術(shù)。
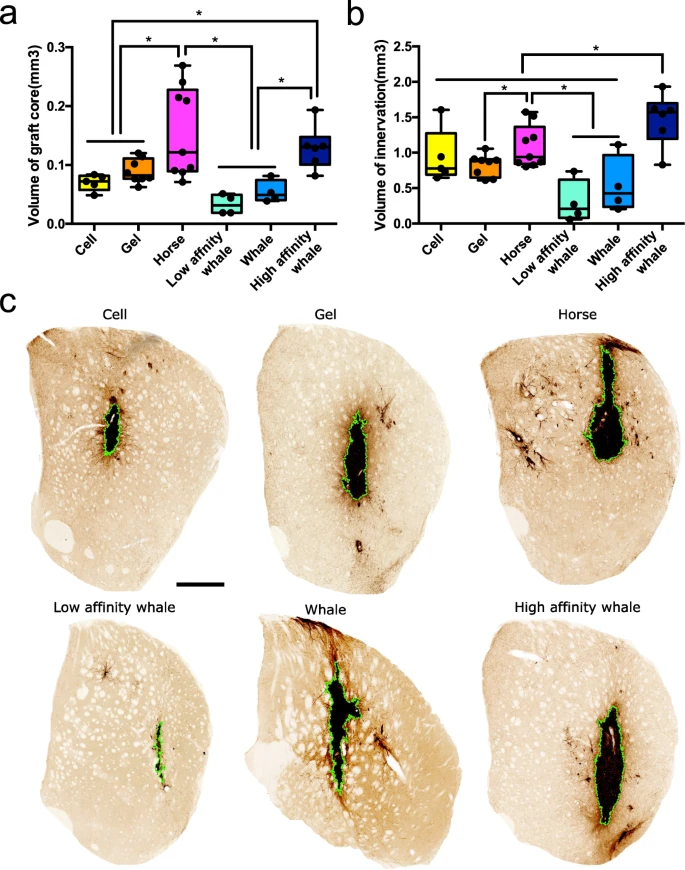
圖3 在SAP中摻入肌紅蛋白可提高移植物存活率和移植物神經(jīng)支配
墨爾本大學教授Clare Parish負責進行小鼠實驗,他說,這一結(jié)果是在受傷的腦組織中取得的,這增加了培養(yǎng)新組織用于未來人類治療的可能性。“我們看到,含有肌紅蛋白和干細胞的水凝膠修復了受傷的腦組織。在水凝膠注入后28天的分析顯示,與不含肌紅蛋白的水凝膠相比,健康大腦功能所需的新干細胞的存活率和生長顯著提高。”“我們觀察到,新組織可以以類似于健康腦組織的方式受到刺激,這首次證明了在水凝膠中加入氧氣輸送以實現(xiàn)干細胞移植的長期存活和整合的好處。”
開發(fā)水凝膠的團隊由墨爾本大學教授David Nisbet、澳大利亞國立大學(ANU)教授Colin Jackson領(lǐng)導。Nisbet教授說:“在中風等受傷后,大腦中有一個死亡區(qū)域,包括其中的循環(huán)系統(tǒng)。所以,我們需要一個臨時的血液供應(yīng)來支持細胞,直到血液系統(tǒng)修復。這種專利水凝膠提供了這一點。
Jackson教授說:“概念證明現(xiàn)已在小鼠大腦中得到證實,但這項研究代表了開發(fā)可注射納米材料的廣泛策略,用于各種應(yīng)用,包括細胞移植、基因和藥物傳遞、3D體外疾病模型和器官芯片技術(shù)。”“很少有藥物治療可以治療中風或帕金森病等疾病,而且效果甚微。目前還沒有可以逆轉(zhuǎn)這些狀況的治療方法。”這一突破將引起全球研究人員和臨床醫(yī)生的興趣,并可能導致許多革命性的醫(yī)療方法。
參考資料:
[1] Hydrogel oxygen reservoirs increase functional integration of neural stem cell grafts by meeting metabolic demands
摘要:腦損傷的干細胞治療一個關(guān)鍵是待治療部位缺少血液輸送氧氣維持移植細胞代謝。墨爾本大學開發(fā)了一種添加血紅蛋白的水凝膠能夠讓干細胞存活足夠長的時間維持恰好的氧水平,動物實驗表明新凝膠能顯著提高小鼠的腦損傷部位的移植干細胞生存分化。
墨爾本大學和澳大利亞國立大學的研究人員開發(fā)了一種新的“混合”水凝膠,可以讓臨床醫(yī)生安全地將干細胞輸送到小鼠的腦損傷部位,文章發(fā)表在《Nature Communications》。這一概念驗證突破解決了干細胞研究人員自20世紀80年代以來面臨的一個重大挑戰(zhàn)——讓干細胞存活足夠長的時間,使它們能夠在被注入身體受損部位后能分化生成新組織所需的細胞。

圖1 研究人員開發(fā)了新的水凝膠可以安全地將干細胞輸送到小鼠的腦損傷部位
水凝膠是一種水基凝膠,可用于將物質(zhì)輸送到體內(nèi),并可用于促進新細胞的有效生長。文章中這種新型的水凝膠能為干細胞提供氧氣,以保持干細胞在注射過程中存活,并確保干細胞分化成創(chuàng)造新組織以修復損傷所需的細胞類型。研究人員認為,這一進展將有利于包括大腦和中樞神經(jīng)系統(tǒng)在內(nèi)的身體許多部位的干細胞治療。
用于遞送、支持和整合干細胞的可注射生物材料在組織再生方面具有重要前景,因為它們可以快速有效地填充待治療部位的空隙,以確保良好的組織接觸。在調(diào)整這些材料的物理化學性質(zhì)以適應(yīng)基于附著的細胞所需要的參數(shù)方面,已經(jīng)取得了重大進展。但是由于注射部位一般缺乏血管化,移植細胞依賴于通過組織擴散到移植物部位的氧氣生存。這對于需要不斷進行代謝的活細胞來說是一個顯著限制,尤其是當它們在自然血管生成機制開始之前的重要早期階段迫切需要氧氣持時,這顯著限制了任何修復大范圍缺損的嘗試。事實上,已有研究表明,在缺氧或缺血環(huán)境中,神經(jīng)元存活率降低。然而,這一技術(shù)挑戰(zhàn)非常重大,因為雖然低氧水平(低于2%)可導致細胞死亡,但顯然高氧水平也可能誘導破壞性效應(yīng)。除了呼吸和能量產(chǎn)生需要氧氣之外,氧氣還是定義細胞命運的過程(如中樞神經(jīng)系統(tǒng)[CNS]細胞前體細胞的凋亡和分化)的重要信號分子。據(jù)了解,腦內(nèi)氧化應(yīng)激的主要促發(fā)因素是細胞內(nèi)活性氧(ROS)水平升高,而ROS已被證明可促進少突膠質(zhì)細胞和其他CNS衍生物的凋亡。理想范圍內(nèi)的氧穩(wěn)態(tài)水平對神經(jīng)元祖細胞的生存、增殖和分化至關(guān)重要。

圖2 本研究中檢測了不同的肌紅蛋白變體
在體外和體內(nèi)實驗中,釋氧生物材料已成為新型工程組織中細胞代謝的非血管支持的新方式。大部分注意力都集中在使用過氧化氫(H2O2)來控制和延長氧氣輸送,但H2O2的存在可能導致自由基的產(chǎn)生增加,盡管這可以在一定程度上通過在多組分系統(tǒng)中摻入酶(如過氧化氫酶)來克服。氟化化合物,特別是全氟化碳(pfc),由于其具有生物惰性且易于溶解氧氣,已被探索用作生物材料中的釋氧佐劑。盡管PFC功能化生物材料具有潛力,但它們無法在血管化之前的時間內(nèi)維持氧水平是一個顯著的缺陷。另一種方法是利用天然存在的氧結(jié)合蛋白,如肌紅蛋白(Mb),將氧直接運輸?shù)浇M織。Mb已被用于在軟骨組織工程過程中刺激干細胞的氧合。這一解決方案為臨床可轉(zhuǎn)化的治療提供了更有前景的途徑,因為Mb可促進氧氣沿氧分壓梯度運輸,從而充當氧氣儲存庫。Mb在高氧濃度下通過輔基血紅素有效結(jié)合氧氣(形成氧合肌紅蛋白),并在低氧條件下釋放氧氣(產(chǎn)生脫氧肌紅蛋白),例如代謝活動增加期間的情況。雖然蛋白(如Mb)在改善細胞移植結(jié)局方面具有顯著潛力,但不能簡單地將其注射到干細胞移植物的特定部位來影響細胞命運,因為它們會迅速降解并彌散離開病灶部位,而需要連續(xù)輸入。
研究人員于是嘗試在一種已被證實具有干細胞輸送能力的水凝膠中加入肌紅蛋白來結(jié)合和釋放氧氣。經(jīng)過五年的研究,研究小組發(fā)現(xiàn),一種基于肌紅蛋白的合成蛋白質(zhì)——在抹香鯨和馬的心肌中高濃度存在的一種天然蛋白質(zhì)——添加到水凝膠中,提供了確保干細胞在輸送過程中存活下來并發(fā)育成修復腦組織所需的細胞類型所需的持續(xù)氧氣釋放。鯨魚和其他深潛動物被認為在它們的肌肉組織中進化出了高濃度的肌紅蛋白,這樣它們就可以在潛水時慢慢地吸收盡可能多的氧氣。同樣,馬被認為進化出了更高濃度的肌紅蛋白,因此它們可以跑更遠的距離。
小鼠實驗結(jié)果表明新型水凝膠應(yīng)用于移植物部位時,可以顯著提高CNS內(nèi)干細胞移植技術(shù)的療效,促進移植的皮質(zhì)神經(jīng)干細胞在腦內(nèi)的長期存活和整合。這些結(jié)果是在遭受醫(yī)源性損傷的破壞腦組織中取得的。體內(nèi)移植后28天的組織學分析顯示,與無Mb水凝膠相比,移植的神經(jīng)干細胞存活率顯著提高,并向成熟神經(jīng)元分化。研究人員觀察到Mb存在時內(nèi)源性組織的廣泛神經(jīng)支配,這首次證明了在功能性水凝膠中結(jié)合生物吸入氧輸送,對協(xié)同促進干細胞移植的長期存活和整合具有重要意義。最后,通過使用不同氧親和力的Mb突變體,他們證明了氧釋放與功能整合相關(guān),為實驗觀察提供了分子解釋。這代表了一種開發(fā)組織模擬、易于注射的納米材料的普遍策略,具有多種應(yīng)用,包括在細胞移植、基因和藥物遞送、3D體外疾病模型和芯片器官技術(shù)。

圖3 在SAP中摻入肌紅蛋白可提高移植物存活率和移植物神經(jīng)支配
墨爾本大學教授Clare Parish負責進行小鼠實驗,他說,這一結(jié)果是在受傷的腦組織中取得的,這增加了培養(yǎng)新組織用于未來人類治療的可能性。“我們看到,含有肌紅蛋白和干細胞的水凝膠修復了受傷的腦組織。在水凝膠注入后28天的分析顯示,與不含肌紅蛋白的水凝膠相比,健康大腦功能所需的新干細胞的存活率和生長顯著提高。”“我們觀察到,新組織可以以類似于健康腦組織的方式受到刺激,這首次證明了在水凝膠中加入氧氣輸送以實現(xiàn)干細胞移植的長期存活和整合的好處。”
開發(fā)水凝膠的團隊由墨爾本大學教授David Nisbet、澳大利亞國立大學(ANU)教授Colin Jackson領(lǐng)導。Nisbet教授說:“在中風等受傷后,大腦中有一個死亡區(qū)域,包括其中的循環(huán)系統(tǒng)。所以,我們需要一個臨時的血液供應(yīng)來支持細胞,直到血液系統(tǒng)修復。這種專利水凝膠提供了這一點。
Jackson教授說:“概念證明現(xiàn)已在小鼠大腦中得到證實,但這項研究代表了開發(fā)可注射納米材料的廣泛策略,用于各種應(yīng)用,包括細胞移植、基因和藥物傳遞、3D體外疾病模型和器官芯片技術(shù)。”“很少有藥物治療可以治療中風或帕金森病等疾病,而且效果甚微。目前還沒有可以逆轉(zhuǎn)這些狀況的治療方法。”這一突破將引起全球研究人員和臨床醫(yī)生的興趣,并可能導致許多革命性的醫(yī)療方法。
參考資料:
[1] Hydrogel oxygen reservoirs increase functional integration of neural stem cell grafts by meeting metabolic demands



